Сурагч лабораториос A хэмээн тэмдэглэгдсэн давсны хүчил (HCl)-н уусмал авч В хэмээн тэмдэглэгдсэн натрийн гидроксид (NaOH)-н уусмалаас нэмж уусмалын орчинг саармаг болтол туршилтыг явуулжээ.
А уусмалын орчинг тодорхойлно уу
…………………………………………………………………………………………[
Хүчиллэг
Бусад хариулт
В уусмалын орчинг тодорхойлно уу
…………………………………………………………………………………………
Суурилаг
Бусад хариулт
Явагдсан урвалын тэгшитгэлийг бичнэ үү
………………………………………………………………………………………
HCl + NaOH = NaCl + H2O
Үгэн тэгшитгэл бичсэн бол
Бусад хариулт
Явагдсан урвалыг нэрлэнэ үү
…………………………………………………………………………………………
Саармагжих урвал
Бусад хариулт
Зурагт үзүүлсэн универсаль индикаторын рН хуваарьт тэмдэглэгдсэн бодисын усан уусмалуудын ямар орчинтой болохыг тодорхойлно уу.
A уусмалын орчинг тодорхойлно уу
……………………………………………………………………………………
Хүчтэй хүчиллэг
Бусад хариулт
B уусмалын орчинг тодорхойлно уу
…………………………………………………………………………………………
Сул хүчиллэг
Бусад хариулт
C уусмалын орчинг тодорхойлно уу
…………………………………………………………………………………………
Саармаг
Бусад хариулт
D уусмалын орчинг тодорхойлно уу
…………………………………………………………………………………………
Сул суурилаг
Бусад хариулт
E уусмалын орчинг тодорхойлно уу
…………………………………………………………………………………………
Хүчтэй суурилаг
Бусад хариулт
Дараах химийн урвалууд явагдах эсэхийг тодорхойлж явагдахгүй тохиолдолд урвалын тэгшитгэлийн бүтээгдэхүүн хэсэгт Х тэмдэглэгээг хийж, явагдах тохиолдолд үүсэх бүтээгдэхүүн бодисуудын томьёог тодорхойлно уу .
Ca + HCl =
…………………………………………………………………………………………
CaCl2, H2
Аль нэгийг тодорхойлсон эсвэл үгээр бичсэн тохиолдолд
Бусад хариулт
Ag + HCl =
…………………………………………………………………………………………[
X тэмдэглэгээ хийсэн тохиолдолд
Өөр тэмдэглэгээ хийсэн тохиолдолд
K + H2SO4 =
…………………………………………………………………………………
K2SO4, H2
Аль нэгийг тодорхойлсон эсвэл үгээр бичсэн тохиолдолд
Бусад хариулт
Кальцийн хлоридын давсыг 3 янзын аргаар гарган авчээ. Өгөгдсөн урвалын тэгшитгэлээс дагалдах бүтээгдэхүүн болох X, Y, Z нэгдлүүдийг тодорхойлно уу.
Ca + 2HCl = CaCl2 + X
CaCO3 + 2HCl = CaCl2 + H2O + Y
Ca(OH)2 + 2HCl = CaCl2 + 2Z
Х бодисыг тодорхойлно уу
…………………………………………………………………………………………[
H2 эсвэл устөрөгч
Бусад хариулт
У бодисыг тодорхойлж (томьёог бичиж), нэрлэнэ үү
…………………………………………………………………………………………
СО2, нүүрсхүчлийн хий
Нэр томьёоны аль нэгийг бичсэн тохиолдолд
Бусад хариулт
Z бодисыг тодорхойлж (томьёог бичиж), нэрлэнэ үү
…………………………………………………………………………………………
H2О, ус
Нэр томьёоны аль нэгийг бичсэн тохиолдолд
Бусад хариулт
Өгөгдлийг ашиглан дараах асуултанд хариулна уу
а. Нар б. Нүүрс в. Салхи г. Газрын тос д. Ус е. Байгалийн хий
Сэргээгдэх эрчим хүчийг нэрлэнэ үү
........................................................................................................................
2-г нэрлэсэн тохиолдолд
1 нэрлэсэн тохиолдолд
нэрлээгүй бол
Үл сэргээгдэх эрчим хүчийг нэрлэнэ үү
.............................................................................................................................
б, г, е 2-г хариулсан тохиолдолд
Бусад хариулт
Устөрөгчийн түлш сэргээгдэх болон үл сэргээгдэх эрчим хүчний аль болохыг нэрлээрэй
.............................................................................................................................
Сэргээгдэх эрчим хүч
Бусад хариулт
Байгаль орчинд ээлтэй, уснаас гаргаж авдаг, түгээх зардал бага, хөнгөн гэх зэрэг давуу талтай түлшийг нэрлэнэ үү
.............................................................................................................................
Устөрөгчийн түлш
Бусад хариулт
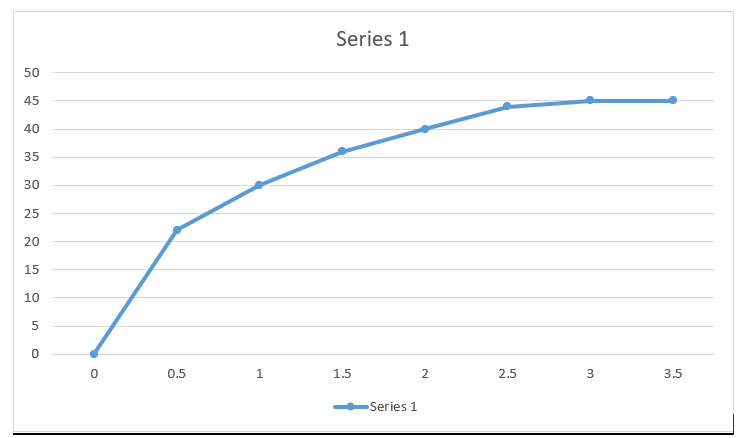
Сурагч 250С-д нэгэн урвалыг явуулж зурагт үзүүлсэн үр дүнг гарган авчээ.
Урвалын температурын өөрчлөлтийг тодорхойлно уу ............................................
31.2
Бусад хариулт
Экзотермийн эсвэл эндотермийн урвалын аль нь болохыг тодорхойлно уу .............................
Экзотерм
Бусад хариулт
Урвалын дүнд дулаан ялгарсан эсвэл шингээгдсэн аль нь болохыг тодорхойлно уу
...................................................
Дулаан ялгаруулсан
Бусад хариулт
Энэ урвалын хувьд химийн холбоо тасрахад .......................... энерги нь шинээр холбоо үүсэхэд ................…… буй энергиэс их байна.
Ялгаруулсан энерги (дулаан)
Энерги, дулааны өөрчлөлт
Бусад хариулт
Зураг дээрх A, B, C, D-г нэрлэнэ үү
A бол . . . . . . . . . . . . . . . . . . . .
Эх бодис (-н энерги, энтальпи)
Бусад хариулт
B бол . . . . . . . . . . . . . . . . . . .
Бүтээгдэхүүн бодис (-н энерги, энтальпи)
Бусад хариулт
C бол . . . . . . . . . . . . . . . . . . .
Идэвхжлийн энерги
Бусад хариулт
D бол . . . . . . . . . . . . . . . . .
Шингээгдсэн энерги (дулаан)
Энерги, дулааны өөрчлөлт
Бусад хариулт
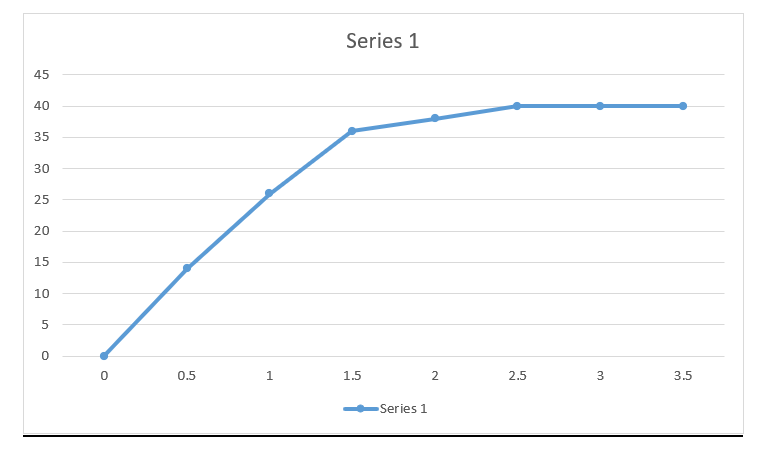
Зураг дээрх A, B, C, D-г нэрлэнэ үү
A бол . . . . . . . . . . . . . . . . . .
Эх бодис, (-н энерги, энтальпи)
Бусад хариулт
B бол . . . . . . . . . . . . . . . . .
Бүтээгдэхүүн бодис (-н энерги, энтальпи)
Бусад хариулт
C бол . . . . . . . . . . . . . . . . . .
Идэвхжлийн энерги
Бусад хариулт
D бол . . . . . . . . . . . . . . . . . .
Ялгаруулсан энерги (дулаан)
Хангалтгүй хариулт (шингээгдсэн, зөрүү)
Буруу хариулт
Сурагч 250С-д буй давсны хүчлийн уусмал дээр нунтаг магнийг нэмж туршилтыг явуулахад дулааны өөрчлөлт ажиглагджээ.
Урвалын дүнд уусмалын температур өссөн бол дулаан ялгаруулах эсвэл шингээх урвалын аль нь болохыг тодорхойлно уу ............................................
Дулаан ялгаруулах
Бусад хариулт
Урвалын дүнд уусмалын температур өссөн бол экзотермийн эсвэл эндотермийн урвалын аль нь болохыг тодорхойлно уу ............................................
Экзотерм
Бусад хариулт
Урвалын эцэст уусмалын температур хэд байхыг таамаглана уу .........
25-100 хооронд утга
Бусад хариулт
Энэ урвалын хувьд химийн холбоо тасрахад .......................... энерги нь шинээр холбоо үүсэхэд ................…… буй энергиэс бага байна
“Зарцуулагдах” эсвэл “шаардлагатай” , “ялгарч” эсвэл “чөлөөлөгдөж
Аль нэгийг хариулсан тохиолдолд
Бусад хариулт
Сурагч 440С-д буй давсны хүчлийн уусмал дээр калийн гидрокарбонатыг нэмж туршилтыг явуулахад дулааны өөрчлөлт ажиглагджээ.
Урвалын дүнд уусмалын температур буурсан бол дулаан ялгаруулах эсвэл шингээх урвалын аль нь болохыг тодорхойлно уу ............................................
Дулаан шингээх
Бусад хариулт
Урвалын дүнд уусмалын температур буурсан бол экзотермийн эсвэл эндотермийн урвалын аль нь болохыг тодорхойлно уу ............................................
Эндотерм
Бусад хариулт
Урвалын эцэст уусмалын температур хэд байхыг таамаглана уу .........
0-44 хооронд утга
Бусад хариулт
Энэ урвалын хувьд химийн холбоо тасрахад .......................... энерги нь шинээр холбоо үүсэхэд ................…… буй энергиэс их байна.
“Зарцуулагдах” эсвэл “шаардлагатай” , “ялгарч” эсвэл “чөлөөлөгдөж
Аль нэгийг хариулсан тохиолдолд
Бусад хариулт
Калийн перманганатын уусмал өгөгджээ. Дараах асуултанд хариулна уу KMnO4 нэгдэл дэх шилжилтийн металлыг нэрлэнэ үү
…………………………………………………………………………………………[\
Mn
Бусад хариулт
KMnO4 буюу марганцын уусмал ямар өнгөтэй вэ?
…………………………………………………………………………………………
Нил ягаан
Бусад хариулт
Нэгдэл дэх химийн элемент манганы өөр ямар нэгэн химийн нэгдлийн жишээ гаргана уу …………………………………………………………………………………[\
Ямар нэгэн жишээ гаргасан бол
Бусад хариулт
Шилжилтийн металлуудын бусад металлаас ялгаатай 2 шинжийг нэрлэнэ үү
…………………………………………………………………………………………
Өнгөт нэгдэл үүсгэдэг, хайлах, буцлах харьцангуй өндөр
Аль нэгийг нэрлэсэн бол
Бусад хариулт
Калийн перманганатын уусмал өгөгджээ. Дараах асуултанд хариулна уу
KMnO4 нэгдэл дэх шилжилтийн металлыг нэрлэнэ үү
…………………………………………………………………………………………
Mn
Бусад хариулт
KMnO4 буюу марганцын уусмал ямар өнгөтэй вэ?
…………………………………………………………………………………………
Ягаан
Бусад хариулт
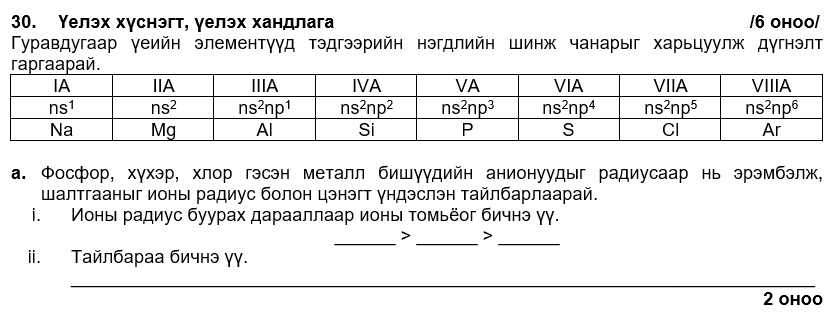
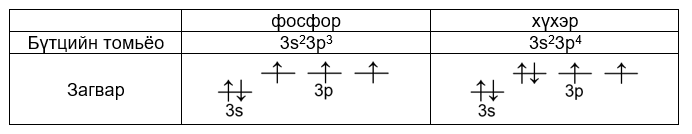
i. P3- > S2- > Cl-
ii. ионы цэнэг ихсэхэд радиус өсч их эзлэхүүн эзэлнэ.
.png)
i.
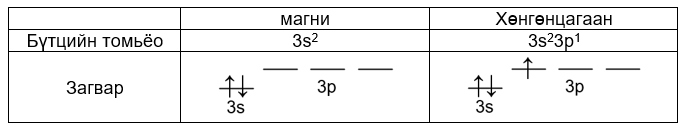
ii. хөнгөнцагааны атомын 3pх1 электрон нь 3s2 хос электроноор цөмөөсөө халхлагдана.

SiO2, P2O5, SO3, Cl2O7

i. Al3+ < Mg2+ < Na+
ii. ионы цэнэг ихсэхэд радиус буурч бага эзлэхүүн эзэлнэ. Үл байршсан электроны тоо олон болно.
.png)
i.
ii. хүхрийн атомын 3pх2 хос электроны түлхэлцэлээс шалтгаална.

Na2O, MgO, Al2O3
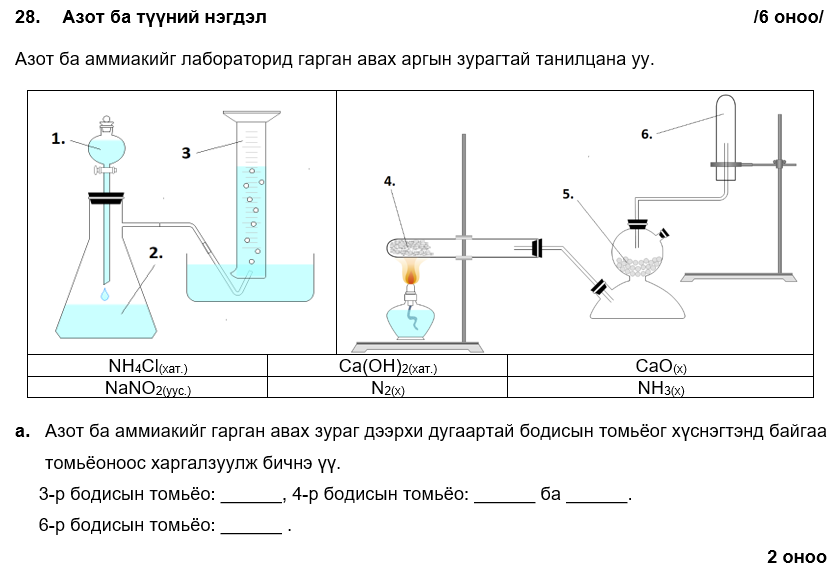
1-р бодис: N2, 4-р бодис: Ca(OH)2 ба NH4Cl,6-р бодис: NH3
.png)
i. Ca(OH)2(хат.) + 2NH4Cl(хат.) → CaCl2(хат.) + 2NH3(х) + 2H2O(ш)
эсвэл CaO(хат.) + 2NH4Cl(хат.) → CaCl2(хат.) + 2NH3(х) + H2O(ш)
ii. аммиак чийгтэй улаан лакмусийн цаасыг хөх өнгөтэй болгоно.

i. 3H2(х) + N2(х) → 2NH3(х)
ii. 5.58
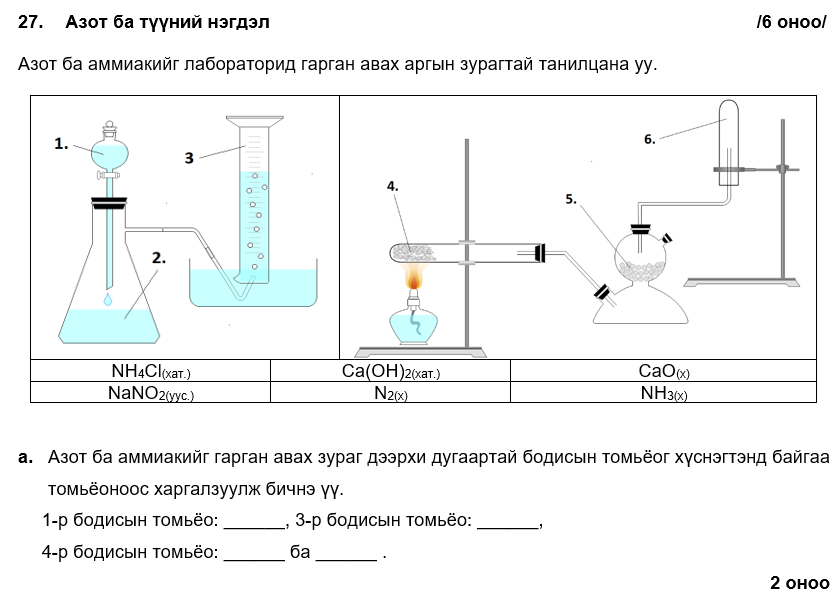
1-р бодис: NH4Cl, 3-р бодис: N2, 4-р бодис: Ca(OH)2 ба NH4Cl
i. NH4Cl(уус.) + NaNO2(уус.) → NaCl(уус.) + N2(х) + H2O(ш)
ii. азотыг хураан авсан саванд ассан зомгол оруулахад унтарна.

i. 3H2(х) + N2(х) → 2NH3(х)
ii. 11.16
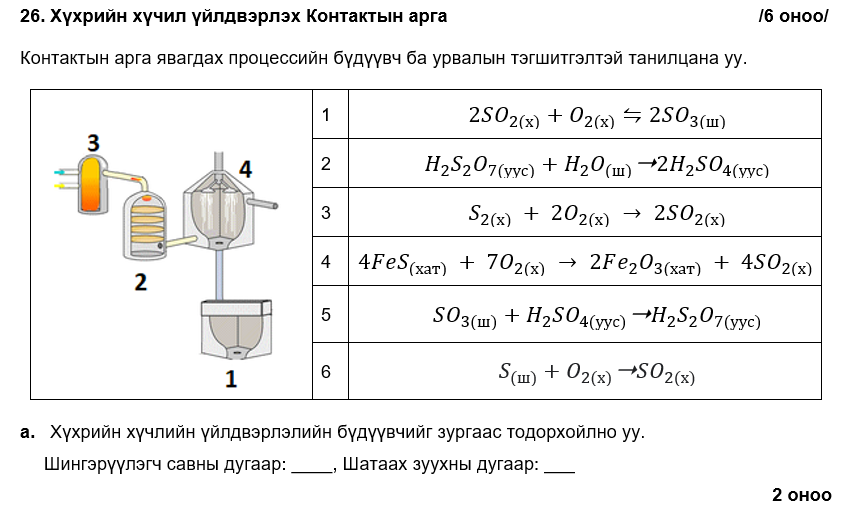
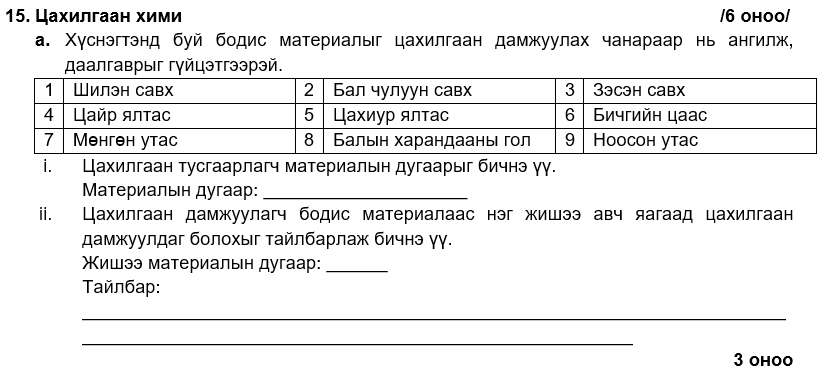
1, 3

i. 4, 6
ii. 1

i. 2
ii. 40
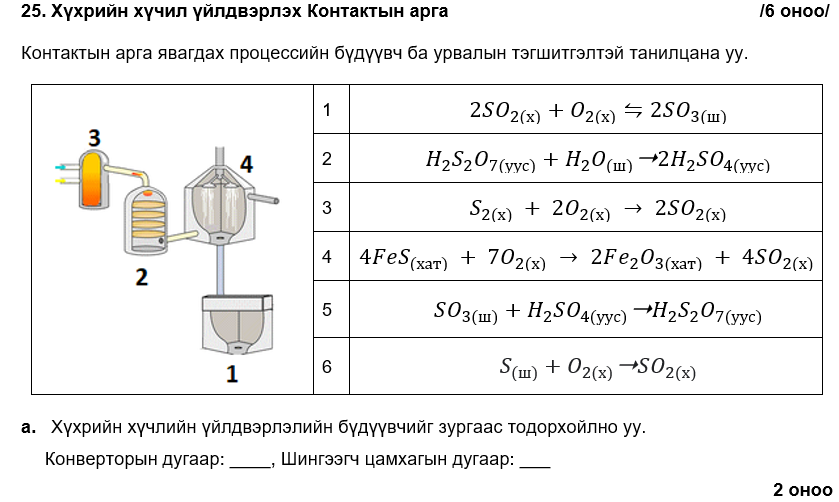
1, 3

i. 1
ii. 2, 5

i. 2
ii. 80
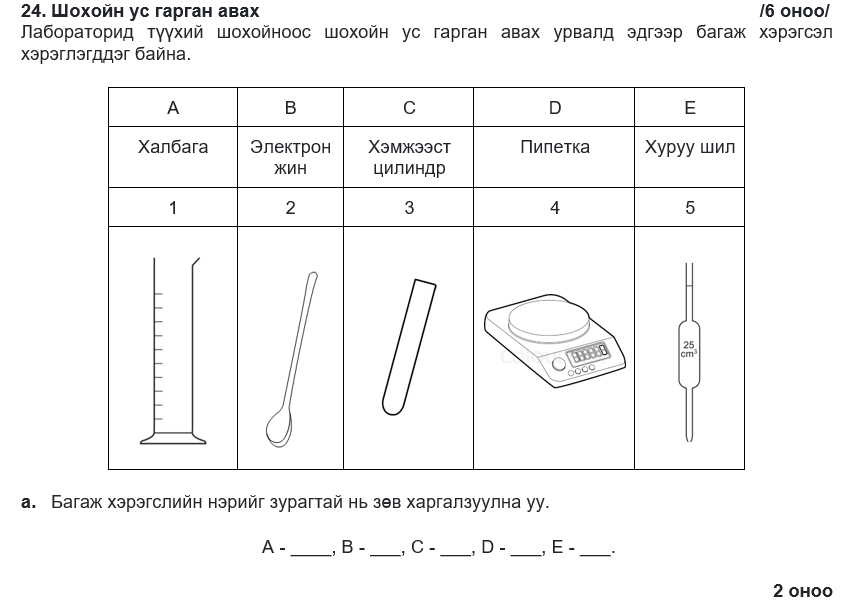
A-2, B-4, C-1, D-5, E-3
i. фенолфталейн эсвэл лакмусын улаан
ii. Ca(OH)2(уус.) ⇔ Ca2+(уус.) + 2OH-(уус.)

i. Ca(OH)2(уус.) + CO2(х) → CaCO3(хат.) + H2O(х)
ii. 99.2
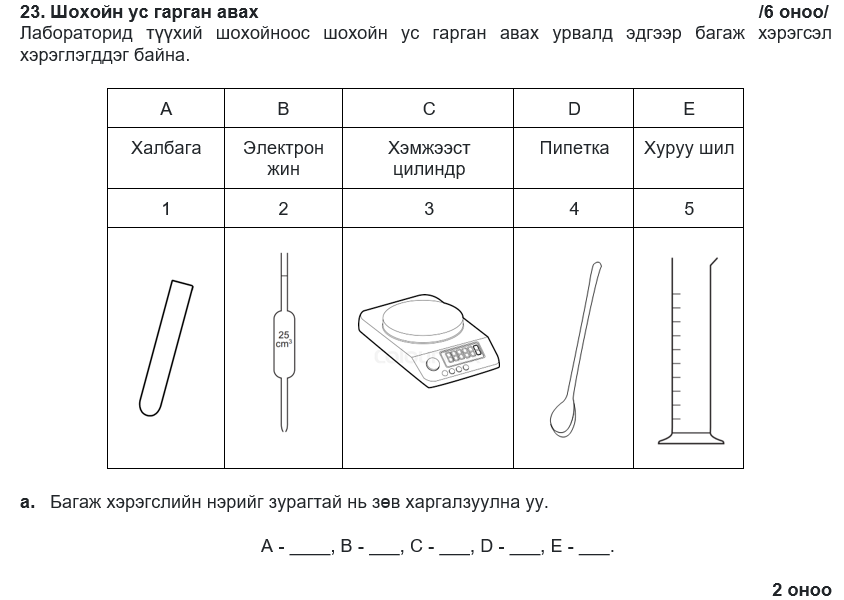
A-4, B-3, C-5, D-2, E-1
i. фенолфталейн эсвэл лакмусын улаан
ii. Ca(OH)2(уус.) ⇔ Ca2+(уус.) + 2OH-(уус.)

i. Ca(OH)2(уус.) + CO2(х) → CaCO3(хат.) + H2O(х)
ii. 49.6
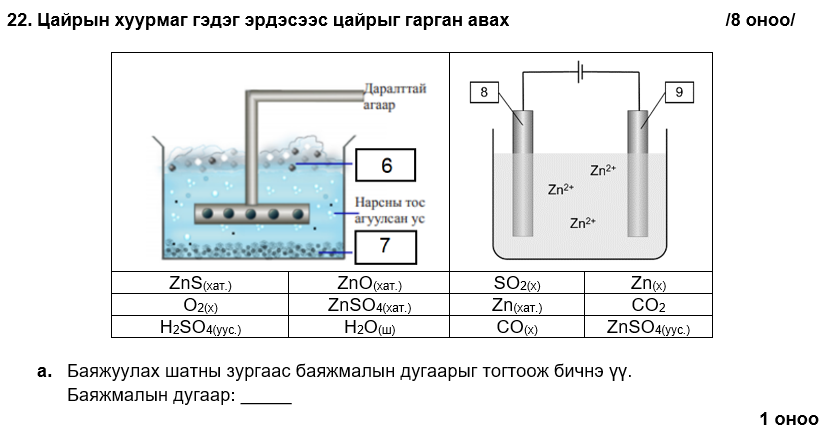
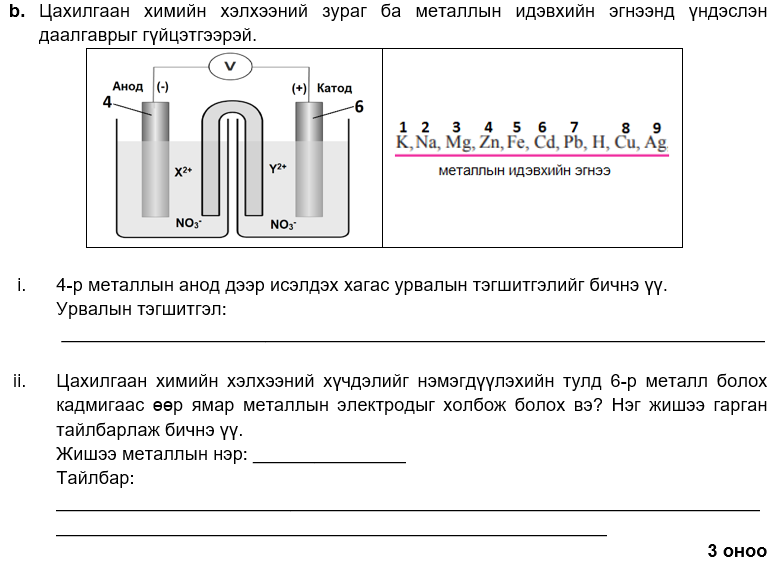
6

i. ZnO, SO2
ii. ZnO(хат.) + CO(х) → Zn (хат.) + CO2(х)
iii. Zn(хат.) → Zn(х)

i. 8
ii. Zn (хат.) → Zn2+(уус.) + 2e-
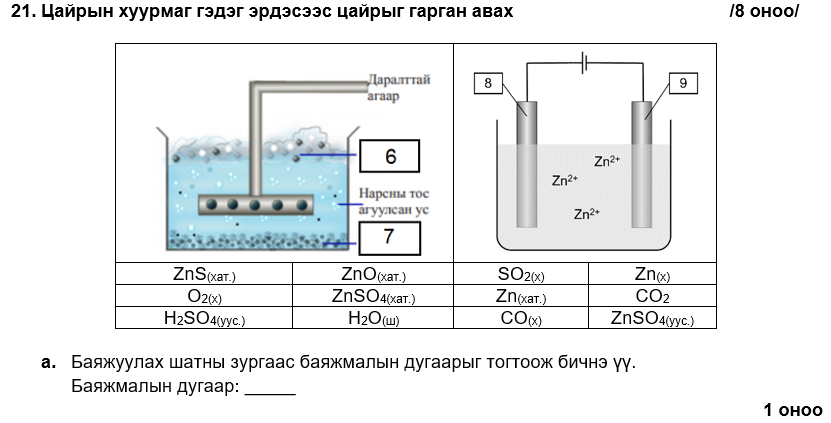
6

i. 2ZnS(хат.) + 3O2(х) → 2ZnO(хат.) + 2SO2(х)
ii. Zn, CO2
iii. Zn(хат.) → Zn(х)

i. 9
ii. Zn2+(уус.) + 2e- → Zn (хат.)

i. бүтээгдэхүүний энтальпигаас эх бодисынх их байна.
ii. ∆үүс.Hº, KCl = -411 кЖ∙моль-1
iii. ∆үүс.H, KCl < 0 учраас харьцангуй тогтвортой байх хандлагатай.

i. K(хат.) + 1/2Cl2(х) → KCl(хат.); ∆урв.Hº = -436.8 кЖ∙моль-1
ii. 174.72
iii. 31.2
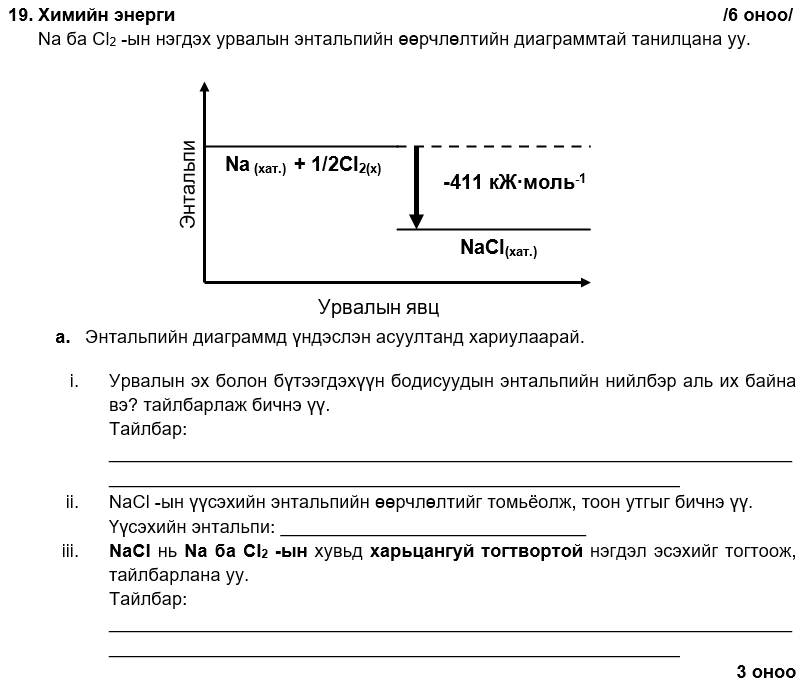
i. бүтээгдэхүүний энтальпигаас эх бодисынх их байна.
ii. ∆үүс.Hº, NaCl = -411 кЖ∙моль-1
iii. ∆үүс.H, NaCl < 0 учраас харьцангуй тогтвортой байх хандлагатай.

i. Na(хат.) + 1/2Cl2(х) → NaCl(хат.); ∆урв.Hº = -411 кЖ∙моль-1
ii. 246.6
iii. 18.4

i. NaNO2, натрийн нитрит
ii. Na3N, NH3
исэлдэхүйн хэм бага байх тусам ангижруулагч хүч их байх хандлагатай.
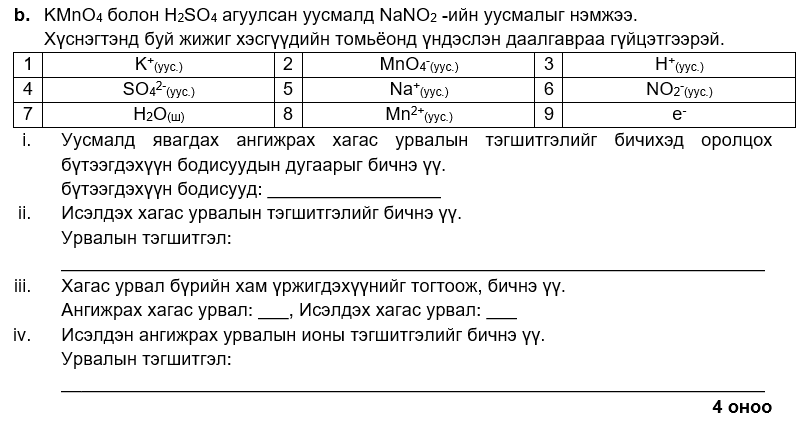
i. 7, 8
ii. NO2- + H2O → NO3- + 2H+ + 2e-
iii. 2, 5
iv. 2MnO4- + 6H+ + 5NO2- → 2Mn2+ + 5NO3- + 3H2O

i. Na2SO3, натрийн сульфит
ii. Na2S, H2S
исэлдэхүйн хэм бага байх тусам ангижруулагч хүч их байх хандлагатай.
.png)
i. 2,3, 9
ii. SO32- + H2O → SO42- + 2H+ + 2e-
iii. 2, 5
iv. 2MnO4- + 6H+ + 5SO32- → 2Mn2+ + 5SO42- + 3H2O
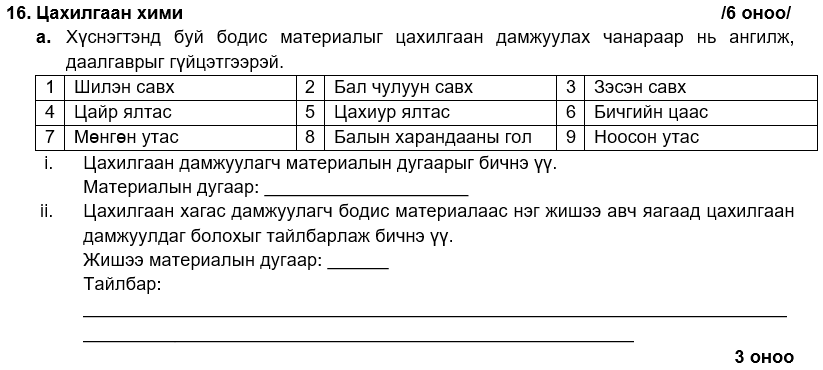
i. 3, 4, 7
ii. 2, 5, 8
КСТОТ -ын үелэсэн давхрааны дундуур дөрөв дэх электкрон сугарч цахилгаан дамжуулна.
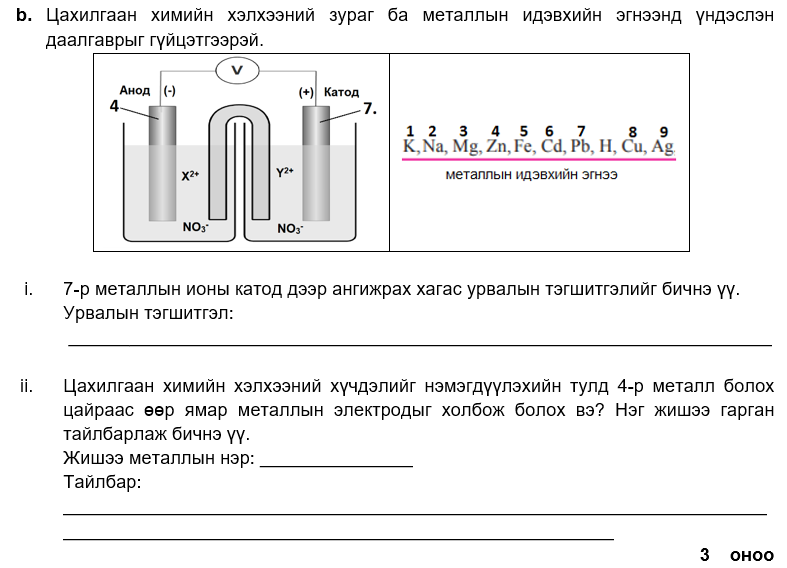
i Pb2+ + 2e- → Pb
ii. кали, натри, магни
цайраас идэвхитэй металл болно.
i. 1, 6, 9
ii. 3, 4, 9
МeТОТ нь металлын катионууд ба үл байршсан электронтой
i Zn → Zn2+ + 2e-
ii хартугалга, зэс, мөнгө
кадмигаас идэвхи муу металл болно.

i. шулуун урвал, гарц
ii. экзотерм, бүтээгдэхүүн бодис
iii. урвалын хаоьцаа, бүтээгдэхүүн бодис

i. 6
ii.
.png)
iii. 3

i. шулуун урвал, гарц
ii. экзотерм, эх бодис, гарц
iii. гарц, эх бодис
.png)
i. 8
ii.
.png)
iii. 3

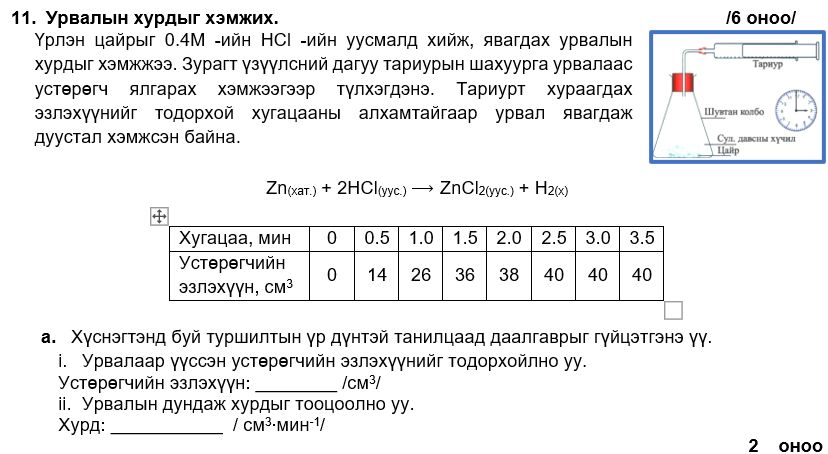
i. 3
ii. 15

i. идэвхитэй мөргөлдөлтийн давтамж буурч хурд буурна
ii. нэгж эзлэхүүн дэх жижиг хэсгийн тоо өссөн учраас хурд ихсэнэ.
i. 40
ii. 16

i. бодисыг нунтаглахад идэвхитэй мөргөлдөлтийн давтамж нэмэгдэгдж урвалын хурд ихсэнэ.
ii. нэгж эзлэхүүн дэх жижиг хэсгийн тоо буурахад урвалын хурд буурна.
2, 6

3
.png)
Mg + H2SO4 → MgSO4 + H2

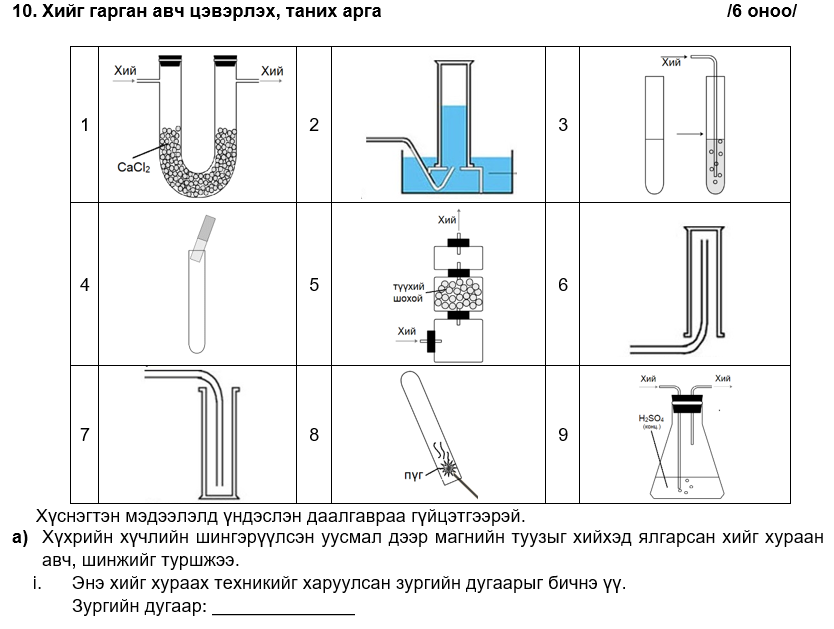
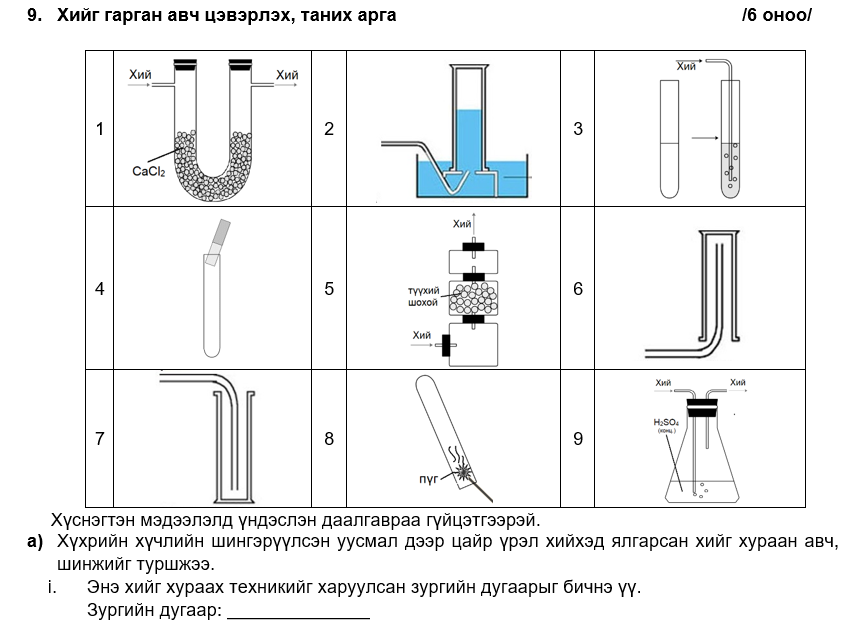
i. агаараас хүнд учраас амсрыг нь өөд нь харуулсан саванд хураан авч болно эсвэл усанд уусдаггүй хий тул усыг түрүүлэх замаар хураан авч болно
ii. 1,9 бөгөөд кальцийн хлоридоор ямарч хийг хатааж болно эсвэл хүчиллэг хий учраас конц хүхрийн хүчлээр хатаана.
2, 6

8

Zn + 2HCl → ZnCl2 + H2

i. агаараас хүнд хий эсвэл усанд уусдаггүй хий
ii. зургийн дугаар -1, 9 бөгөөд кальцийн хлоридоор ямарч хийг хатааж болно эсвэл хүчиллэг хий учраас конц. хүхрийн хүчлээр хатаана.
.png)
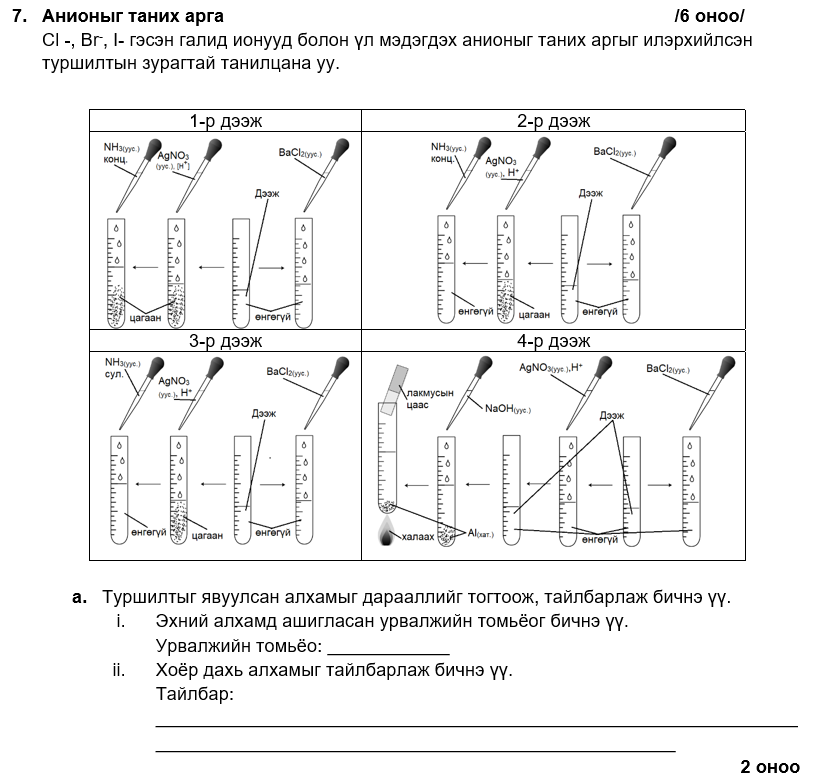
i. AgNO3
ii. барийн хлоридын уусмал нэмэхэд тунадас үүсэх эсэхийг шалгах

i. 2
ii. концентрацтай аммиакийн уусмалд AgBr уусна.

i. нитрат
ii. урвалаар үүссэн аммиак лакмусын улаан цаасыг хөх өнгөтэй болгоно.
i. BaCl2
ii. AgNO3 -ын уусмал нэмэхэд тунадас үүсэх эсэхийг шалгах

i. 3
ii. сулруулсан аммиакийн уусмалд AgCl уусна.
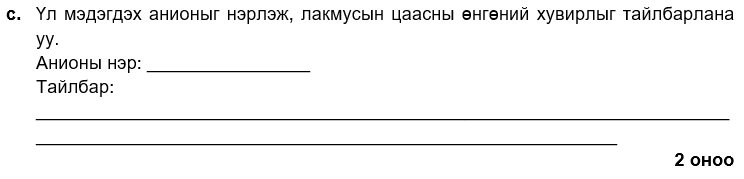
i. нитрат
ii. урвалаар үүссэн аммиак закмусын улаан цаасыг хөх өнгөтэй болгоно.
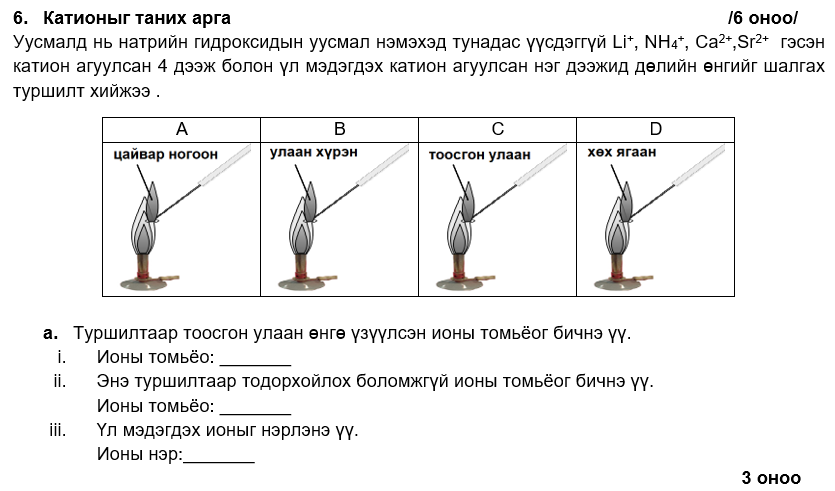
i. Ca2+
ii. NH4+
iii. барийн ион

i. IV, VI
ii. Pb2+ + 2OH- → Pb(OH)2
эсвэл Al3+ + 3OH- → Al(OH)3
iii. NaOH -ын уусмалыг илүүдлээр нэмнэ
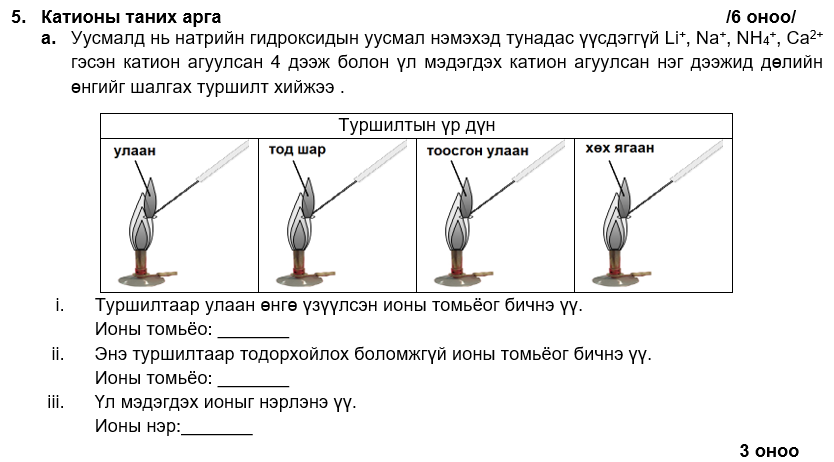
i. Li+
ii. NH4+
iii. калийн ион

i. IV, VI
ii. Mg2+ + 2OH- → Mg(OH)2
эсвэл Al3+ + 3OH- → Al(OH)3
iii. NaOH -ын уусмалыг илүүдлээр нэмнэ

i. 5, 2
ii. 1,4

i. 2
ii. 118-121ºС -ийн мужид хольц нь хайлна.

i. 2, 5
ii. 1, 4
.png)
i. 3
ii. 118ºC-121ºC гэсэн мужид хольц нь хайлна.

i. этанол ба ацетон
ii. уснаас бага температурт буцалдаг